Campath
Informace Na Stránce Nepředstavují Lékařskou Radu. Nic Neprodáváme. Přesnost Překladu Není Zaručena. Zřeknutí Se Odpovědnosti
Shrnutí drog
Co je CamPath?
Campath (Alemtuzumab) je protilátka vyrobená ze zvířecí DNA používané k léčbě chronické lymfocytární leukémie. Campath se obvykle podává poté, co byly jiné léky vyzkoušeny bez úspěšné léčby.
Jaké jsou vedlejší účinky Campath?
Campath může způsobit vážné vedlejší účinky včetně:
- kopřivka
- potíže s dýcháním
- Otok vašeho obličeje rty jazyk nebo krk
- horečka
- zimnice
- nevolnost
- Lightheadedness
- vyrážka
- síť
- bolest na hrudi
- Problémy s viděním řečového myšlení nebo pohybem svalu
- Snadné modřiny
- neobvyklé krvácení
- fialové nebo červené skvrny pod kůží
- vředy
- Vředy
- bolest v krku
- kašel
- bledá nebo zažloutlá kůže
- tmavě zbarvená moč
- zmatek
- neobvyklá slabost
- dušnost
- Studené ruce a nohy
- Otok ve vašich dolních nohách
- přibývání na váze
- Ztráta chuti k jídlu
- náhlá bolest v žaludku nebo zádech a
- moč, která vypadá růžově hnědá nebo pěna
Získejte lékařskou pomoc okamžitě, pokud máte výše uvedené příznaky.
Mezi běžné vedlejší účinky Campath patří:
- horečka
- zimnice
- závrať
- ztuhlost svalu
- Bolest kloubů nebo svalů
- nevolnost
- zvracení
- Ztráta chuti k jídlu
- Bolest břicha
- bolest hlavy
- průjem
- vyrážka or itching
- kopřivka
- únava
- Problémy se spánkem (nespavost)
- úzkost
- únava
- kašel
- pocení nebo
- potíže s dýcháním během nebo po infuzi.
Tyto vedlejší účinky se objevují častěji během prvního týdne léčby Campath. Řekněte svému lékaři, pokud máte vážné vedlejší účinky Campath, včetně:
- dušnost
- Změny duševní/nálady (jako je depresivní úzkost)
- kost nebo Bolest zad
- Svazm svalu
- neobvyklá slabost
- otoky kotníků nebo nohou
- žloutnutí kůže nebo očí
- změny množství moči
- bolestivé močení
- růžová nebo krvavá moč
- otupělost nebo brnění paží nebo nohou nebo
- Bolest/zarudnutí/otok zbraní/nohou/místo injekce.
Pokud máte následující vážné vedlejší účinky, vyhledejte lékařskou péči nebo zavolejte na číslo 911:
- Vážné příznaky očí, jako je ztráta náhlého vidění rozmazané vidění vidění Vision Vision Eye Eye Eye Eye Eye Eye Eye Eye nebo vidět halos kolem světel;
- Vážné příznaky srdce, jako je rychlé nepravidelné nebo bušení srdečního rytmu; třepování v hrudi; dušnost; a náhlé závratě lightheadness nebo omdlení;
- Těžká zmatek bolesti hlavy zkažená paže řeči nebo slabost nohou Potíže se ztrátou chůze pocitu koordinace Nestabilní velmi tuhé svaly vysoké horečky bohaté pocení nebo třes.
Tento dokument neobsahuje všechny možné vedlejší účinky a mohou dojít k jiným. Další informace o vedlejších účincích najdete u svého lékaře.
Dávkování pro Campath
Campath Léky jsou podávány intravenózně pod dohledem lékaře obvykle po 2 hodiny. Dávkování je založeno na reakci pacienta na léčbu. Pacienti se obvykle začínají s nízkou dávkou léku a dávka může být pomalu zvýšena.
Jaké léky nebo doplňky interagují s Campath?
Jiné léky mohou ovlivnit Campath. Řekněte svému lékaři o všech lécích na předpis a volně prodejné léky, které používáte. To zahrnuje vitamínové minerály bylinné produkty a léky předepsané jinými lékaři. Nezačínejte používat nový lék, aniž byste řekli svému lékaři.
Jak se cítíte Gabapentin
Campath během těhotenství a kojení
Během těhotenství by se Campath měl používat pouze tehdy, když je předepsán. Doporučuje se, aby muži a ženy, kteří dostávali tento lék, používali během léčby tímto lékem a po dobu nejméně 6 měsíců po dobu nejméně 6 měsíců. Není známo, zda tento lék přechází do mateřského mléka. Kvůli možnému riziku kojení kojeneckého kojení se při použití tohoto léčiva nedoporučuje během léčby tímto lékem a po dobu nejméně 3 měsíců poté.
Další informace
Naše CamPath (alemtuzumab) vedlejší účinky drogové centrum poskytuje komplexní pohled na dostupné informace o drogách o potenciálních vedlejších účincích při užívání tohoto léku.
Informace o drogách FDA
- Popis léku
- Indikace
- Vedlejší účinky
- Varování
- Předávkovat
- Klinická farmakologie
- Průvodce léky
VAROVÁNÍ
Infuzní reakce a infekce cytopenias
Cytopenie
U pacientů, kteří dostávají Campath, se může objevit vážná včetně fatální pancytopenie/hrowow hypoplasie autoimunitní idiopatická trombocytopenie a autoimunitní hemolytické anémie. Jednotlivé dávky CAMPATH větší než 30 mg nebo kumulativní dávky větší než 90 mg týdně zvyšují výskyt pancytopenie [viz varování a OPATŘENÍ ].
Infuzní reakce
Campath Administration může vést k vážným včetně fatálních infuzních reakcí. Pečlivě sledujte pacienty během infuzí a zadržujte Campath pro infuzní reakce třídy 3. nebo 4. Postupně eskalovat Campath do doporučené dávky při zahájení terapie a po přerušení terapie po dobu 7 nebo více dnů [viz viz Dávkování a podávání a varování a OPATŘENÍ ].
Infekce
U pacientů, kteří dostávají Campath, se může objevit vážné včetně fatálních bakteriálních virových plísňových a protozoanských infekcí. Spravujte profylaxi proti pneumonii Pneumocystis Jiroveci (PCP) a infekce virů herpes [viz viz Dávkování a podávání a varování a OPATŘENÍ ].
Popis pro Campath
Campath (Alemtuzumab) je rekombinantní DNA-odvozená humanizovaná monoklonální protilátka (CamPath-1H) namířená proti glykoproteinu CD52 na buněk 21–28 kD. Campath-1H je protilátka IgG1 Kappa s lidskou variabilním rámcem a konstantními oblastmi a komplementaritamidereminujícími regiony z myší (potkaní) monoklonální protilátky (Campath-1G). Protilátka Campath-1H má přibližnou molekulovou hmotnost 150 kD. Campath se vyrábí v kultuře suspenze savčích buněk (čínský křeček) v médiu obsahujícím neomycin. Neomycin není v konečném produktu detekovatelný.
Campath je sterilní čirý bezbarvý izotonický roztok (pH 6,8–7,4) pro injekci. Každá jednorázová lahvička CamPath obsahuje 30 mg alemtuzumab 8,0 mg chloridu sodného sodného 1,44 mg dibasického fosfátu sodného 0,2 mg chloridu draselného 0,2 mg monobasického fosfátu draselného 0,1 mg polysorbátu 80 a 0,0187 mg disodium edetát. Nejsou přidány žádné konzervační látky.
Použití pro Campath
Campath je označen jako jediný činidlo pro léčbu chronické lymfocytární leukémie B-buněk (B-CLL).
Dávkování pro Campath
Plán dávkování a správa
- Spravujte jako intravenózní infuze po dobu 2 hodin. Nepodporujte jako intravenózní tlak nebo bolus.
- Doporučený režim dávkování
- Postupně eskalujte na maximální doporučenou jednu dávku 30 mg. Eskalace je vyžadována při zahájení dávkování nebo pokud se dávkování během léčby udržuje ≥ 7 dní. Eskalace na 30 mg běžně lze provést za 3 až 7 dní.
- Strategie eskalace
- Spravujte 3 mg denně, dokud nejsou reakce související s infuzí ≤ stupeň 2 [viz viz Nežádoucí účinky ].
- Poté podávejte 10 mg denně, dokud reakce související s infuzí nejsou ≤ stupeň 2.
- Poté podávejte 30 mg/den třikrát týdně za alternativní dny (např. Mon-Wed-Pá). Celková doba trvání terapie včetně eskalace dávky je 12 týdnů.
- Jednotlivé dávky větší než 30 mg nebo kumulativní dávky vyšší než 90 mg týdně zvyšují výskyt pancytopenie.
Doporučené souběžné léky
- Předpokládejte difenhydramin (50 mg) a acetaminofen (500-1000 mg) 30 minut před první infuzí a každou eskalací dávky. Institut vhodné lékařské řízení (např. Glukokortikoidy epinefrin meperidin) pro reakce související s infuzí podle potřeby [viz viz VAROVÁNÍS AND OPATŘENÍ a Nežádoucí účinky ].
- Podávejte trimethoprim/sulfamethoxazol dvojitou pevnost (DS) dvakrát denně 3krát týdně (nebo ekvivalentní) jako profylaxi pneumocystis jirovecii (PCP).
- Spravujte famciclovir 250 mg nabídku nebo ekvivalentu jako herpetická profylaxe.
Pokračujte v PCP a Herpes virové profylaxi po dobu minimálně 2 měsíce po dokončení Campath nebo do doby, kdy počet CD4 je ≥ 200 buněk/μl, podle toho, co se objeví později [viz viz VAROVÁNÍS AND OPATŘENÍ ].
Modifikace dávkování
- Campath během vážné infekce nebo jiných závažných nežádoucích účinků až do řešení.
- Přerušte Campath pro autoimunitní anémii nebo autoimunitní trombocytopenii.
- Pro lymfopenii nejsou doporučeny žádné modifikace dávky.
Modifikace dávky pro neutropenii nebo trombocytopenie [viz varování a preventivní opatření]
| Hematologické hodnoty | Modifikace dávkování* |
| Anc <250/μL a/or platelet count ≤25000/μL | |
| Pro první výskyt: | Zadržovat terapii CAMPATH. Pokračujte v CamPath při 30 mg, když ANC ≥ 500/μl a počet destiček ≥ 50000/μl. |
| Pro druhý výskyt: | Zadržovat terapii CAMPATH. Pokračujte v Campath při 10 mg, když ANC ≥ 500/μl a počet destiček ≥ 50000/μl. |
| Pro třetí výskyt: | Ukončete terapii CAMPATH. |
| > 50% pokles oproti základní linii u pacientů iniciujících terapii s základní ANC ≤ 250/μl a/nebo základní počet destiček ≤ 25000/μl | |
| Pro první výskyt: | Zadržovat terapii CAMPATH. Pokračujte v CamPath při 30 mg po návratu na základní hodnotu (hodnoty). |
| Pro druhý výskyt: | Zadržovat terapii CAMPATH. Pokračujte v CamPath při 10 mg po návratu na základní hodnotu (hodnoty). |
| Pro třetí výskyt: | Ukončete terapii CAMPATH. |
| * Pokud je zpoždění mezi dávkováním ≥ 7 dnů iniciováno terapií v CamPath 3 mg a eskalací na 10 mg a poté na 30 mg, jak je tolerováno [viz viz Dávkování a podávání ]. |
Příprava a správa
Před podáváním by se měly být vizuálně kontrolovány parenterální léčivé přípravky na to, zda jsou vizuálně na částice a zbarvení. Pokud je přítomna částice nebo je roztok zbarven zlikvidujte lahvičku. Netřásněte lahvičkou.
Použijte aseptickou techniku během přípravy a podávání Campath. Získejte potřebné množství Campath z lahvičky do stříkačky.
- Příprava 3 mg dávky odstoupí 0,1 ml do 1 ml stříkačky kalibrované v přírůstcích 0,01 ml.
- Příprava 10 mg dávky odstoupí 0,33 ml do 1 ml stříkačky kalibrované v přírůstcích 0,01 ml.
- Pro přípravu 30 mg dávky stažení 1 ml buď 1 ml nebo 3 ml stříkačky kalibrované v 0,1 ml přírůstku.
Injekční obsah injekční stříkačky do 100 ml sterilního 0,9% chloridu sodného USP nebo 5% dextrózy ve vodě USP. Jemně převrátíte tašku a smíchejte roztok. Vyhodit stříkačku.
Vial neobsahuje žádné konzervační látky a je určena pouze pro jedno použití. Po stažení dávky zlikvidujte lahvičku včetně jakékoli nevyužité části.
Použijte do 8 hodin po zředění. Ukládejte zředěný Camplath při teplotě místnosti mezi 15 ° C až 30 ° C (59 ° F až 86 ° F) nebo chlazeným při 2 ° C až 8 ° C (36 ° F až 46 ° F). Chránit před světlem.
Nekompatibility
Campath je kompatibilní s polyvinylchloridovými (PVC) sáčky a PVC nebo polyethylen lemovanými podávacími sadami PVC. Nepřidávejte ani současně inturujte jiné léčivé látky stejnou intravenózní linií.
Jak dodáno
Formy a silné stránky dávkování
Injekce : 30 mg/1 ml jako jasné bezbarvé řešení v lahvičce s jednou dávkou
Skladování a manipulace
Campath (Alemtuzumab) je dodáván v čiré skleněné jednotné lahvičce obsahující 30 mg Alemtuzumabu v 1 ml roztoku. Každý karton obsahuje tři lahvičky CamPath ( NDC 58468â0357-3) nebo jedna Campath Vial ( NDC 58468-0357-1).
Ukládejte Campath při 2 ° C až 8 ° C (36 ° F až 46 ° F). Ne zmrazení. Pokud se před podáním náhodně zmrazí rozmrazení při 2 ° C až 8 ° C. Chránit před přímým slunečním světlem.
Vyráběno a distribuováno: Genzyme Corporation Cambridge MA 02142 US Licenční číslo: 1596. Revidováno: APP 2023
Vedlejší účinky pro Campath
Následující klinicky významné nežádoucí účinky jsou podrobněji diskutovány v jiných částech štítku:
- Cytopenie [see VAROVÁNÍS AND OPATŘENÍ ]
- Reakce související s infuzí [viz VAROVÁNÍS AND OPATŘENÍ ]
- Imunosuprese/infekce [viz VAROVÁNÍS AND OPATŘENÍ ]
Zkušenosti z klinických studií
Protože klinické studie se provádějí za široce měnících se podmínek, nežádoucí rychlost nežádoucí reakce pozorovaná v klinických studiích léčiva nelze přímo porovnat s mírami v klinických studiích s jiným lékem a nemusí odrážet míru pozorované v praxi.
Níže uvedená data odrážejí vystavení Campathovi u 296 pacientů s CLL, z nichž 147 bylo dříve neošetřeno a 149 obdrželo alespoň 2 předchozí chemoterapeutické režimy. Střední doba expozice byla 11,7 týdnů u dříve neléčených pacientů a 8 týdnů u dříve léčených pacientů.
The most common adverse reactions with CAMPATH are: infusion-related reactions (pyrexia chills hypotension urticaria nausea rash tachycardia dyspnea) cytopenias ( neutropenia lymphopenia thrombocytopenia anemia) infections (CMV viremia CMV infection other infections) gastrointestinal symptoms (nausea emesis abdominal pain) a neurologické příznaky (úzkost nespavosti). Nejběžnějšími závažnými nežádoucími reakcemi jsou reakce související s infuzí cytopenií a imunosuprese/infekce.
Lymfopenie
U dříve neošetřených a dříve léčených pacientů po podání Campath po podání CAMPATH se vyskytlo závažné lymfopenie a rychlé a trvalé pokles podskupin lymfocytů. U dříve neléčených pacientů byl medián CD4 0 buněk/μl v měsíci po ošetření a 238 buněk/μl [25%-75% mezikvartilní rozmezí 115 až 418 buněk/μl po 6 měsících po léčbě [viz viz viz VAROVÁNÍS AND OPATŘENÍ ].
Neutropenie
U dříve neléčených pacientů byl výskyt neutropenie stupně 3 nebo 4 42% se středním časem na nástup 31 dnů a střední dobou trvání 37 dnů. U dříve léčených pacientů byl výskyt neutropenie stupně 3 nebo 4 64% se střední dobou trvání 28 dnů. Deset procent dříve neléčených pacientů a 17% dříve léčených pacientů dostávalo faktory stimulujících kolonie granulocytů.
Anémie
U dříve neléčených pacientů byl výskyt anémie třídy 3 nebo 4 12% se střední dobou do 31 dnů a střední dobou trvání 8 dnů. U dříve léčených pacientů byl výskyt anémie třídy 3 nebo 4 38%. Sedmnáct procent dříve neléčených pacientů a 66% dříve léčených pacientů dostávalo buď erytropoézové přenosy stimulujících látek nebo obojí.
kolik dilaudid je příliš mnoho
Trombocytopenie
U dříve neléčených pacientů byl výskyt trombocytopenie stupně 3 nebo 4 14% se středním časem na nástup 9 dnů a střední délkou trvání 14 dnů. U dříve léčených pacientů byl výskyt trombocytopenie stupně 3 nebo 4 52% s průměrnou dobou trvání 21 dnů. Autoimunitní trombocytopenie byla hlášena u 2% dříve léčených pacientů s jednou smrtelností.
Reakce související s infuzí
Reakce související s infuzí, které zahrnovaly Pyrexia zimnicí hypotenze a dušnost byla běžná. Pyrexie a/nebo zimnice třídy 3 a 4 se vyskytly přibližně u přibližně 10% dříve neléčených pacientů a přibližně u 35% dříve léčených pacientů. Výskyt reakcí souvisejících s infuzí byl největší během počátečního týdne léčby a snížil se s následnými dávkami Campath. Všichni pacienti byli předem ošetřeni antipyretikou a antihistaminikou; Kromě toho 43% dříve neošetřených pacientů dostávalo předběžnou léčbu glukokortikoidů.
Infekce
Ve studii dříve neléčených pacientů byl testován každý týden na CMV s použitím testu PCR od zahájení po dokončení terapie a každé 2 týdny po dobu prvních 2 měsíců po terapii. K infekci CMV došlo u 16% (23/147) dříve neošetřených pacientů; Přibližně jedna třetina těchto infekcí byla vážná nebo ohrožující život. Ve studiích dříve léčených pacientů, u nichž byl rutinní dohled CMV vyžadován, byla infekce CMV zdokumentována u 6% (9/149) pacientů; Téměř všechny tyto infekce byly vážné nebo ohrožující život.
Jiné infekce byly hlášeny přibližně u 50% pacientů ve všech studiích. Stupeň 3 až 5 sepse se pohybovala od 3% do 10% napříč studiemi a byla vyšší u dříve léčených pacientů. Febrilní neutropenie třídy 3 až 4 se pohybovala od 5% do 10% napříč studiemi a byla vyšší u dříve léčených pacientů. Úmrtí související s infekcí došlo u 2% dříve neléčených pacientů a 16% dříve léčených pacientů. U 109 dříve neošetřených pacientů bylo 198 epizod jiné infekce; 16% bylo bakteriálních 7% bylo plísní 4% bylo jiných virových a v 73% nebyl organismus identifikován.
Srdeční
Srdeční dysrhythmias occurred in approximately 14% of previously untreated patients. The majority were tachycardias a were temporally associated with infusion; dysrhythmias were Grade 3 or 4 in 1% of patients.
Dříve neléčené pacienti
Tabulka 1 obsahuje vybrané nežádoucí účinky pozorované u 294 pacientů randomizovaných (1: 1), aby dostávali Campath nebo chlorambucil jako terapii první linie pro B-CLL. Campath byl podáván v dávce 30 mg intravenózně třikrát týdně po dobu až 12 týdnů. Střední doba terapie byla 11,7 týdnů se střední týdenní dávkou 82 mg (25%-75% mezikvartilní rozmezí: 6990 mg).
Tabulka 1: Na incidence vybraných pacientů* Nežádoucí účinky u léčby naivních pacientů s B-CLL
| Campath (n = 147) | Chlorambucil (n = 147) | ||||
| Všechny známky † % | Stupně 3-4 % | Všechny známky % | Stupně 3-4 % | ||
| Poruchy krve a lymfatického systému | Lymfopenie | 97 | 97 | 9 | 1 |
| Neutropenie | 77 | 42 | 51 | 26 | |
| Anémie | 76 | 13 | 54 | 18 | |
| Trombocytopenie | 71 | 13 | 70 | 14 | |
| Obecné poruchy a podmínky pro správu | Pyrexia | 69 | 10 | 11 | 1 |
| Zimnice | 53 | 3 | 1 | 0 | |
| Infekce a Infestations | CMV Viremia ‡ | 55 | 4 | 8 | 0 |
| Infekce CMV | 16 | 5 | 0 | 0 | |
| Jiné infekce | 74 | 21 | 65 | 10 | |
| Poruchy kůže a podkožní tkáně | Urticaria | 16 | 2 | 1 | 0 |
| Vyrážka | 13 | 1 | 4 | 0 | |
| Erythema | 4 | 0 | 1 | 0 | |
| Cévní poruchy | Hypotenze | 16 | 1 | 0 | 0 |
| Hypertenze | 14 | 5 | 2 | 1 | |
| Poruchy nervového systému | Bolest hlavy | 14 | 1 | 8 | 0 |
| Tremor | 3 | 0 | 1 | 0 | |
| Respirační hrudní a mediastinální poruchy | Dušnost | 14 | 4 | 7 | 3 |
| Gastrointestinální poruchy | Průjem | 10 | 1 | 4 | 0 |
| Psychiatrické poruchy | Nespavost | 10 | 0 | 3 | 0 |
| Úzkost | 8 | 0 | 1 | 0 | |
| Srdeční Disorders | Tachykardie | 10 | 0 | 1 | 0 |
| * Nežádoucí účinky, které se vyskytují při vyšší relativní frekvenci v Campath ARM † NCI CTC verze 2.0 pro nežádoucí účinky; NCI CTCAE verze 3.0 pro laboratorní hodnoty ‡ CMV virémie (bez důkazu příznaků) zahrnuje jak případy jednotlivých výsledků testu PCR a potvrzenou virémii CMV (≥ 2 příležitosti u po sobě jdoucích vzorků od sebe 1 týden). Pro poslední ganciklovir (nebo ekvivalent) byl zahájen na protokol. |
Dříve léčené pacienty
Další informace o bezpečnosti byly získány ze 3 studií s jedním ramenem u 149 dříve léčených pacientů s CLL, které byly podávány 30 mg campath intravenózně třikrát týdně po dobu 4 až 12 týdnů (střední kumulativní dávka 673 mg [rozmezí 2-1106 mg]; střední trvání terapie 8,0 týdnů). Nežádoucí účinky v těchto studiích, které nejsou uvedeny v tabulce 1, ke které došlo při výskytu 1 5%, byly únavové nevolnosti zmrazení muskuloskeletální bolesti anorexie dysestezizie mukositis a bronchospasm.
Imunogenita
Stejně jako u všech terapeutických proteinů existuje potenciál pro imunogenitu. Výskyt tvorby protilátek je vysoce závislý na citlivosti a specificitě testu. Pozorovaný výskyt protilátky (včetně neutralizační protilátky) pozitivity v testu může být navíc ovlivněn několika faktory, včetně metodiky pro testovací metodiku, která manipuluje načasování vzorku doprovodných léků a základní onemocnění. Z těchto důvodů může být porovnání výskytu protilátek s výskytem protilátek vůči jiným produktům Alemtuzumabu zavádějící.
U 11 ze 133 (8,3%) dříve neošetřených pacientů byly detekovány pomocí testů ELISA Anti-Humánní protilátky (HAHA). Kromě toho byli dva pacienti slabě pozitivní na neutralizační aktivitu. Omezená data naznačují, že protilátky proti campath neovlivnily odpověď nádoru. Bylo zjištěno, že čtyři z 211 (1,9%) dříve léčených pacientů mají po léčbě protilátky proti Campath.
Zážitek z postmarketingu
Campath
Během používání camplath byly identifikovány následující nežádoucí účinky. Protože tyto reakce jsou hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo vytvořit kauzální vztah k expozici léčiva.
Obecné poruchy a podmínky pro správu: Fatální reakce související s infuzí.
Kardiovaskulární poruchy: Kongrestivní srdeční selhání kardiomyopatie snížila ejekční frakci (někteří pacienti byli dříve léčeni kardiotoxickými látkami).
Cerebrovaskulární poruchy: Cervicocefalická arteriální pitva, včetně hemoragické a ischemické mrtvice.
Gastrointestinální poruchy: Akutní acalculous cholecystitis.
Poruchy imunitního systému: Goodpastureova syndrom Gravesova onemocnění Aplastická anémie Guillain-Barré Syndrom Chronická zánětlivá demyelinizační polyradikuloneuropatie sérová nemoc fatální transfúze asociované štěp a hostitelský onemocnění hemofagocytární lymfohistiocytóza (HLH).
Infekce: Progresivní multifokální leukoencefalopatie (PML) reaktivace latentních virů (PML) virus viru epstein-barr (EBV).
Poruchy metabolismu a výživy: Syndrom nádorové lýzy.
Neoplazmy: Lymfoproliferativní porucha spojená s EBV.
Poruchy nervového systému: Optická neuropatie.
Poruchy ledvin a moči: Glomerulární nefropatie.
Další produkty Alemtuzumab
Během postgrapovalu byly identifikovány následující nežádoucí účinky jiného produktu Alemtuzumabu. Protože tyto reakce jsou hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo vytvořit kauzální vztah k expozici léčiva.
Endokrinní poruchy: Hypotyreóza hypertyreóza a tyreoiditida.
Poruchy nervového systému: Autoimunitní encefalitida.
Drogové interakce pro Campath
S Campath nebyly provedeny žádné formální studie interakce léčiva.
Varování pro Campath
Zahrnuto jako součást OPATŘENÍ sekce.
Opatření pro Campath
Cytopenie
U pacientů, kteří dostávají Campath, byly hlášeny závažné včetně fatální autoimunitní anémie a trombocytopenie a prodloužené myelosuprese.
Kromě aplazie aplázie a hypoplasie aplazie a hypoplasie aplazie aplazie aplazie aplazie a aplazie a hypoplasie po léčbě Campath v doporučené dávce. Jednotlivé dávky CAMPATH větší než 30 mg nebo kumulativní dávky větší než 90 mg týdně zvyšují výskyt pancytopenie.
Zadržet Camplath pro těžké cytopenie (s výjimkou lymfopenie). Přerušte autoimunitní cytopenie nebo opakující se/perzistentní těžké cytopenie (s výjimkou lymfopenie) [Viz Dávkování a podávání ]. No data exist on the safety of Campath resumption in patients with autoimmune cytopenias or marrow aplasia [see Nežádoucí účinky ].
Získejte úplný krevní počet (CBC) v týdenních intervalech během CAMPATH terapie a častěji, pokud dochází k zhoršujícímu se anémické neutropenii nebo trombocytopenii. Posoudit počty CD4 po léčbě až do zotavení na ≥ 200 buněk/μl [viz Dávkování a podávání a Nežádoucí účinky ].
Dlouhodobé účinky nikotinové gumy
Reakce související s infuzí
Nežádoucí účinky, ke kterým dochází během nebo krátce po infuzi CamPath, zahrnují pyrexia zimnice/přísnost nevolnost hypotenze věcárního vyrážky a bronchospasm [viz viz Nežádoucí účinky ]. In clinical trials the frequency of infusion-related reactions was highest in the first week of treatment. Monitor for the signs a symptoms listed above a withhold infusion for Grade 3 or 4 infusion-related reactions.
Následující vážné včetně fatálních reakcí souvisejících s infuzí byly identifikovány v ponorkových zprávách: synkopa plicní infiltruje syndrom akutní respirační tísňové syndrom (ARDS) respirační zatčení srdeční arytmie myokardiální infarkt akutní srdeční nedostatky srdeční zatčení angiodeedema a anafylaktoidní šoky.
Zahajte Campath podle doporučeného schématu eskalace dávky [viz Dávkování a podávání ]. Premedicate patients with an antihistamine a acetaminophen prior to each dose. Institute appropriate medical management (e.g. glucocorticoids epinephrine meperidine) for infusion-related reactions as needed [see Dávkování a podávání ]. If therapy is interrupted for 7 or more days reinstitute Campath with gradual dose escalation [see Dávkování a podávání ].
Imunosuprese/infekce
Campath treatment results in severe a prolonged lymphopenia with a concomitant increased incidence of opportunistic infections [see Nežádoucí účinky ]. Administer PCP a herpes viral prophylaxis during treatment with Campath a for a minimum of 2 months after completion of Campath or until the CD4+ count is ≥200 cells/μL whichever occurs later [see Dávkování a podávání ]. Prophylaxis does not eliminate these infections.
Během léčby CAMPATH a po dobu nejméně 2 měsíců po dokončení Campath rutinně sledujte pacienty s infekcí CMV. Odedržte Campath pro vážné infekce a během antivirové léčby infekcí CMV nebo potvrzené CMV virémie (definovaná jako polymerázová řetězová reakce [PCR] pozitivní CMV v ≥2 po sobě jdoucích vzorcích získaných 1 týden od sebe). Iniciate terapeutický ganciklovir (nebo ekvivalentní) pro infekci CMV nebo potvrzenou virémii CMV.
Infekce viru Epstein-Barr (EBV) včetně těžké a fatální hepatitidy spojené s EBV byla hlášena u pacientů, kteří dostávali Campath.
Monitorujte znaky a příznaky infekcí EBV. Zadržet Campath pro reaktivaci EBV nebo závažnou infekci.
Spravujte pouze ozářené krevní produkty, aby se zabránilo štěpu spojené s transfúzí versus hostitelské onemocnění (tagvhd), pokud nevyvažující okolnosti nekomentují okamžitou transfúzi.
U pacientů, kteří dostávali Campath jako počáteční regenerace terapie počtu CD4 na ≥ 200 buněk/μl, došlo do 6 měsíců po dokončení Campath; Po 2 měsících po ošetření však byl medián 183 buněk/μl. U dříve léčených pacientů, kteří dostávali CAMPATH, byl střední čas na zotavení počtu CD4 na ≥ 200 buněk/μl 2 měsíce; Úplné zotavení (k výchozímu linii) počtu CD4 a CD8 však může trvat déle než 12 měsíců [viz Nežádoucí účinky ].
Imunizace
Bezpečnost imunizace živými virovými vakcínami po Campathově terapii nebyla studována. Nedávejte živé virové vakcíny pro pacienty nebo kojence narozené pacientům, kteří dostávají Campath. Schopnost generovat imunitní odpověď na jakoukoli vakcínu po Campathově terapii nebyla studována.
Neklinická toxikologie
Zhodnocení mutageneze karcinogeneze plodnosti
Studie pro posouzení karcinogenního nebo genotoxického potenciálu Campath nebyly provedeny.
Ve studiích plodnosti byl Alemtuzumab (intravenózně) podáván 3 nebo 10 mg/kg) transgenních mužských myší HUCD52 po dobu 5 po sobě jdoucích dnů před soužitím u neošetřených žen divokého typu. Nebyl pozorován žádný účinek na plodnost nebo reprodukční výkon. Při obou testovaných dávkách však byly pozorovány nepříznivé účinky na parametry spermií (včetně abnormální morfologie [oddělená/bez hlavy] a snížená celkový počet a pohyblivost).
Když byl Alemtuzumab (intravenózně) podáván 3 nebo 10 mg/kg) transgenní samic myší HUCD52 po dobu 5 po sobě jdoucích dnů před soužitím neošetřených samců divokého typu, došlo ke snížení průměrného počtu korporátních lutea a implantovacích míst a poimpplantační ztráty v případě, že se snížily při posilovači, které byly ve vyšším testinném pobídlení.
Použití v konkrétních populacích
Těhotenství
Shrnutí rizika
Na základě zjištění ze studií na zvířatech může Campath způsobit poškození plodu při podání těhotné ženě. Dostupné údaje z publikovaných kohortových studií u těhotných žen nejsou dostatečné k tomu, aby bylo možné stanovit riziko asociovaného s velkým vrozeným vadami nebo nepříznivé výsledky matky nebo plodu. Alemtuzumab byl embryoletální u těhotných transgenních myší HUCD52, když byl podáván během organogeneze (viz viz Data ). Je známo, že lidské protilátky IgG překračují placentární bariéru; Proto může být Campath přenášen z matky na vyvíjející se plod. Poraďte ženám o potenciálním riziku plodu. Kojenci narozené těhotným ženám léčeným Campath mohou být vystaveny zvýšenému riziku infekce (viz Klinické úvahy ).
Riziko na pozadí hlavních vrozených vad a potratu pro uvedenou populaci není známo. Všechna těhotenství mají na pozadí riziko ztráty vrozených vad nebo jiných nepříznivých výsledků. V americké obecné populaci je odhadované riziko na pozadí velkých vrozených vad a potratu u klinicky uznávaných těhotenství 2% až 4% a 15% až 20%.
Klinické úvahy
Fetální/novorozenecké nežádoucí účinky
Monoklonální protilátky jsou přepravovány přes placentu, protože těhotenství postupuje s největším množstvím přeneseným během třetího trimestru. Zvažte rizika a výhody podávání živých nebo živých vakcín pro kojence vystavené Campathovi v děloze [viz VAROVÁNÍS AND OPATŘENÍ ].
Data
Údaje o zvířatech
Když byl Alemtuzumab podáván těhotným transgenním myším HUCD52 během organogeneze (gestační dny [GD] 6-10 nebo GD 11-15) při intravenózních dávkách 3 nebo 10 mg/kg nebyly pozorovány teratogenní účinky. U těhotných zvířat během GD 11-15 však došlo ke zvýšení embryolethality (zvýšená ztráta postimplantace a počet přehrad se všemi plody mrtvými nebo resorbovanými). V samostatné studii u těhotných transgenních myší HUCD52 podávání alemtuzumabu během organogeneze (GD 6-10 nebo GD 11-15) při intravenózních dávkách obou popisových dávek při obou dávkách při testovaných dávkách.
U těhotných transgenních myší HUCD52 se během těhotenství a laktací během laktačního období po laktaci při 10 mg/kg došlo k nárůstu transgenních myší HUCD52 v intravenózních dávkách 3 nebo 10 mg/kg/den. Snižování populací T-lymfocytů a B-lymfocytů a v protilátkové odpovědi bylo pozorováno u potomků při obou testovaných dávkách.
Laktace
Shrnutí rizika
Neexistují žádné údaje o přítomnosti alemtuzumabu v účincích lidského mléka na produkci mléka nebo kojeným dítětem. Účinky lokální expozice gastrointestinálního a omezeného systémového expozice u kojeného dítěte na alemtuzumabu nejsou známy. Alemtuzumab byl detekován v mléce laktačních transgenních myší HUCD52 podávaných Alemtuzumab (viz viz Data ). Maternal IgG is known to be present in human milk a when a drug is present in animal milk it is likely that the drug will be present in human milk.
Vzhledem k potenciálu závažných nežádoucích účinků Campath u kojeného dítěte, včetně sníženého počtu lymfocytů, doporučuje kojím ženám kojit během léčby CAMPATH a po dobu nejméně 3 měsíců po poslední dávce.
Data
Alemtuzumab byl detekován v mléce transgenních myší s laktačním HUCD52 po intravenózním podávání Alemtuzumabu v dávce 10 mg/kg v poporodních dnech 8-12. Hladiny séra Alemtuzumabu byly podobné u laktačních myší a potomků v poporodní den 13 a byly spojeny s důkazem farmakologické aktivity (snížení počtu lymfocytů) u potomků.
Ženy a muži reprodukčního potenciálu
Campath may cause embryo-fetal harm when administered to pregnant women [see Použití v konkrétních populacích ].
Těhotenství Testing
Těhotenství testing is recommended for females of reproductive potential prior to initiating Campath therapy.
Antikoncepce
Ženy
Poraďte pacientům s reprodukčním potenciálem k používání účinné antikoncepce během léčby Campath a po dobu nejméně 3 měsíců po poslední dávce.
Neplodnost
Na základě nálezů ze studií na zvířatech může Alemtuzumab narušit plodnost u žen a mužů reprodukčního potenciálu [viz viz Neklinická toxikologie ]. The reversibility of the effect on fertility is unknown.
Celexa a Wellbutrin pro sociální úzkost
Dětské použití
U pediatrických pacientů nebyla stanovena bezpečnost a účinnost Campath.
Geriatrické použití
Ze 147 dříve neléčených pacientů s B-CLL léčených Campath 35% byli ≥ věk 65 a 4% ≥ věku 75 let. Ze 149 dříve léčených pacientů s B-CLL 44% byli ≥ 65 let věku a 10% ve věku ≥ 75 let. Klinické studie Campath nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby se určilo, zda reagují jinak než mladší subjekty. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty.
Informace o předávkování pro Campath
V rámci všech klinických zkušeností byla hlášená maximální přijata jediná dávka 90 mg. U pacientů, kteří dostávali dávku vyšší, než se doporučilo, došlo k infekcím aplazie kostní dřeně nebo závažné reakce související s infuzí.
Jeden pacient, který obdržel intravenózně 80 mg dávky, zažil akutní bronchospasmový kašel a dušnost následovanou anurií a smrtí. Jiný pacient obdržel dvě dávky 90 mg intravenózně jeden den od sebe během druhého týdne léčby a zažil rychlý nástup aplazie kostní dřeně.
Neexistuje žádný známý specifický antidota pro předávkování Campath. Ukončete CamPath a zajistit podpůrnou terapii.
Kontraindikace pro Campath
Žádný.
Klinická farmakologie for Campath
Mechanismus působení
Campath binds to CD52 an antigen present on the surface of B a T lymphocytes a majority of monocytes macrophages NK cells a a subpopulation of granulocytes. A proportion of bone marrow cells including some CD34+ cells express variable levels of CD52. The proposed mechanism of action is antibody-dependent cellular-mediated lysis following cell surface binding of Campath to the leukemic cells.
Farmakodynamika
Srdeční Electrophysiology
Účinek více dávek Alemtuzumabu (12 mg/den po dobu 5 dnů) na interval QTC byl hodnocen v jednoramenné studii u 53 pacientů bez malignity. Ve studii nebyly detekovány žádné velké změny ve středním intervalu QTC (tj.> 20 ms). Průměrné zvýšení srdeční frekvence o 22 až 26 rytmů/min bylo pozorováno po dobu nejméně 2 hodin po počáteční infuzi Alemtuzumabu. Toto zvýšení srdeční frekvence nebylo pozorováno u následujících dávek.
Jak často lze vzít Flexeril
Farmakokinetika
Campath pharmacokinetics were characterized in a study of 30 previously treated B-CLL patients in whom Campath was administered at the recommended dose a schedule. After 12 weeks of dosing patients exhibited a 7-fold increase in mean AUC.
Rozdělení
Po posledních 30 mg dávce byl průměrný objem distribuce v ustáleném stavu 0,18 l/kg (rozmezí 0,1 až 0,4 l/kg).
Odstranění
Campath pharmacokinetics displayed nonlinear elimination kinetics. Systemic clearance decreased with repeated administration due to decreased receptor-mediated clearance (i.e. loss of CD52 receptors in the periphery). Mean half-life was 11 hours (range 2 to 32 hours) after the first 30 mg dose a was 6 days (range 1 to 14 days) after the last 30 mg dose.
Konkrétní populace
Účinky poškození ledvin nebo jater na farmakokinetiku Campath nebyly studovány.
Klinické studie
Dříve neléčené pacienti s B-CLL
Campath was evaluated in an open-label raomized (1:1) active-controlled study in previously untreated patients with B-CLL Rai Stage I-IV with evidence of progressive disease requiring therapy. Patients received either Campath 30 mg intravenously 3 times per week for a maximum of 12 weeks or chlorambucil 40 mg/m² orally once every 28 days for a maximum of 12 cycles.
Z 297 pacientů randomizovalo se střední věk byl 60 let 72% mužů 99% bylo kavkazských 96% mělo výkon WHO 0-1 23% měl maximální průměr lymfatických uzlin ≥ 5 cm 34% bylo RAI stadium III/IV a 8% bylo léčeno v USA
Pacienti randomizovaní k přijímání Campath zažili delší přežití bez progrese (PFS) ve srovnání s těmi, kteří byli randomizováni, aby dostávali chlorambucil (medián PFS 14,6 měsíců vs. 11,7 měsíců). Celková míra odezvy byla 83% a 55% (P <0.0001) a the complete response rates were 24% a 2% (p <0.0001) for Campath a chlorambucil arms respectively. The Kaplan-Meier curve for PFS is shown in Figure 1.
Obrázek 1: Přežití bez progrese u dříve neošetřených pacientů s B-CLL*
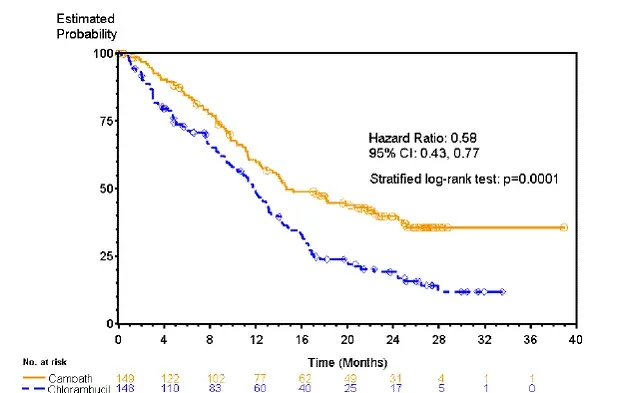 |
* Test log-rank upravený pro fázi RAI (I-II vs. III-IV).
Dříve léčené pacienty s B-CLL
Campath was evaluated in three multicenter open-label single-arm studies of 149 patients with B-CLL previously treated with alkylating agents fludarabine or other chemotherapies. Patients were treated with the recommended dose of Campath 30 mg intravenously 3 times per week for up to 12 weeks. Partial response rates of 21% to 31% a complete response rates of 0% to 2% were observed.
Informace o pacientovi pro Campath
Cytopenie
Poraďte pacientům, aby nahlásili jakékoli známky nebo příznaky, jako je krvácení snadné modřiny petechiae nebo purpura bledová slabost nebo únava [viz VAROVÁNÍS AND OPATŘENÍ a Nežádoucí účinky ].
Reakce související s infuzí
Poraďte pacientům o příznacích a příznacích reakcí souvisejících s infuzí a potřebě předpokládat předpokládání [viz viz VAROVÁNÍS AND OPATŘENÍ a Nežádoucí účinky ].
Imunosuprese/infekce
Poraďte pacientům, aby okamžitě hlásili příznaky infekce (např. Pyrexie) a vzít profylaktické antiinfekční látky pro PCP (Trimethoprim/Sulfamethoxazol DS nebo ekvivalent) a pro virus herpes (famciclovir nebo ekvivalent) [viz [viz [viz [viz [viz [viz) VAROVÁNÍS AND OPATŘENÍ a Nežádoucí účinky ].
Radí pacientům, že je nutné ozáření krevních produktů [viz VAROVÁNÍS AND OPATŘENÍ ].
Imunizace
Poraďte pacientům, že by neměli být imunizováni živými virovými vakcínami, pokud byli nedávno léčeni Campath. Poraďte se ženám s kojenci vystavenými Campathovi v děloze, aby informovali pediatra o expozici [viz VAROVÁNÍS AND OPATŘENÍ ].
Toxicita embryo-fetální
Poraďte se těhotným ženám a ženám reprodukčního potenciálu potenciálního rizika pro plod. Doporučit ženám informovat svého poskytovatele zdravotní péče o známém nebo podezřelém těhotenství [viz Použití v konkrétních populacích ].
Poraďte pacientům s reprodukčním potenciálem k použití účinné antikoncepce během léčby Campath a po dobu 3 měsíců po konečné dávce [viz Použití v konkrétních populacích ].
Laktace
Doporučujte ženám, aby nedošlo k kojení během léčby Campath a po dobu 3 měsíců po konečné dávce [viz Použití v konkrétních populacích ].
Neplodnost
Poraďte se ženám a mužům reprodukčního potenciálu, aby Campath mohl narušit plodnost [viz Použití v konkrétních populacích a Neklinická toxikologie ].
Glomerulární nefropatie
Poraďte pacientům o příznacích a příznacích glomerulárních nefropatií, které se mohou vyskytnout měsíce až roky po obdržení CamPath [viz viz Nežádoucí účinky ].